Biokatalytische Synthese chiraler Synthesebausteine
Bisherige Syntheseverfahren erwiesen sich sowohl in ökologischer als auch in ökonomischer Hinsicht als unbefriedigend.
In diesem Forschungs- und Entwicklungsvorhaben haben die Projektpartner eine neue biokatalytische Syntheseplattform entwickelt, welche den bislang leistungsfähigsten Zugang zu chiralen α-Diolen und α-Hydroxyketonen eröffnet. Der enzymkatalysierte Prozess überzeugt durch unerreicht hohe Selektivitäten und eine gegenüber anderen Verfahren unübertroffene Ökoeffizienz.
Chirale α-Diole und α-Hydroxyketone - wichtige Synthesebausteine
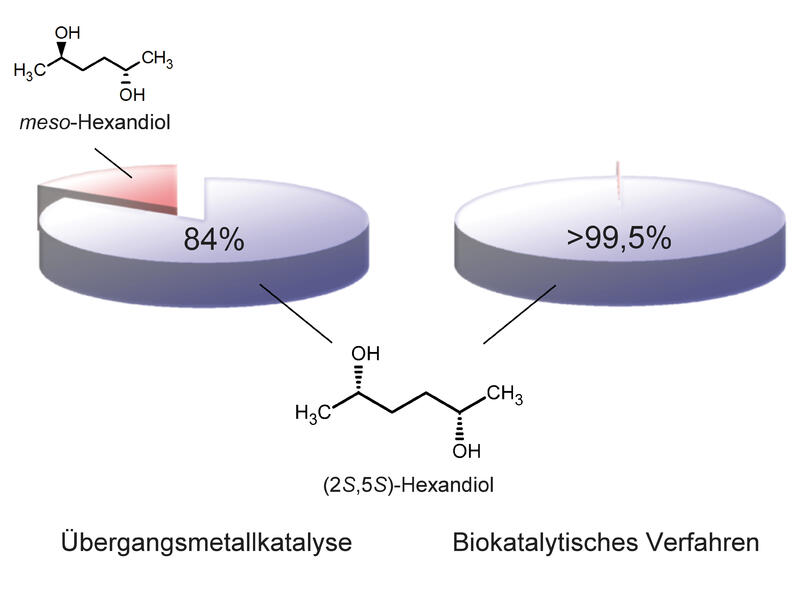
Die mit dem Projekt angestrebte verbesserte Zugänglichkeit chiraler α-Diole, wie (2S,5S)- Hexandiol, ermöglicht eine breitere Verwendung dieser Synthesebausteine im Bereich der Entwicklung neuer Antibiotika, Agrochemikalien oder Polymere.
Der nächstliegende biokatalytische Zugang zum enantiomerenreinen (2S, 5S)-
Hexandiol ist die Reduktion des zugrundeliegenden Diketons 2,5-Hexandion. Als Biokatalysatoren dienen entweder ganze Zellen oder isolierte Enzyme. Der zur Reduktion benötigte Wasserstoff muss dabei durch sogenannte Cofaktoren bereitgestellt werden.
Biokatalytische Syntheseplattform
Ganzzell-biokatalytisch gelingt die Synthese des enantiomerenreinen Diols bzw. Hydroxyketons im Gramm-Maßstab mit der Backhefe Saccharomyces cerevisiae. Eingehende Untersuchungen deckten jedoch zahlreiche Wechselwirkungen zwischen Edukt und Hefezelle auf, die den Einsatz ganzer Zellen limitieren. Alternativ wurde daher der Weg über das Enzym 2,5-Hexandion-Reduktase beschritten, die erstmals erfolgreich aus S. cerevisiae gereinigt wurde und einen selektiven Zugang sowohl zum Diol als auch zum Hydroxyketon liefert. Im Zuge von Verfahrensoptimierungen wurde zusätzlich eine bakterielle Dehydrogenase identifiziert, die nicht nur 2,5-Hexandion selektiv reduziert, sondern auch den benötigten Cofaktor regeneriert.
Die Ergebnisse sind auf andere Dione übertragbar, womit eine ökologisch und ökonomisch unerreicht leistungsfähige
Syntheseplattform für den Zugang zu chiralen Diolen und Hydroxyketonen entwickelt wurde.
Hohe Ökoeffizienz
Das Verfahren ist sehr ressourceneffizient, da die Ausgangstoffe mit hoher Atomökonomie in das Produkt überführt werden. Die entfallende Trennproblematik zur Entfernung unerwünschter Nebenprodukte reduziert die Abfallmengen um bis zu 60 % und spart rund 25 % der benötigten Energie ein. Für die Reduktion von 2,5-Hexandion zum 2,5-Hexandiol werden die Gestehungskosten um rund 80 % reduziert, ein erheblicher ökonomischer Vorteil, der nur aufgrund der hohen ökologischen Effizienz des Verfahrens möglich ist.
Projektthema
Biokatalytische Synthese chiraler α-Diole und α-Hydroxyketone
Projektdurchführung
TU Bergakademie Freiberg
Institut für Technische Chemie
Priv.-Doz. Dr. rer. nat. habil. Martin Bertau
09596 Freiberg
Telefon 03731|39-2384
Telefax 03731|39-2324
martin.bertau@chemie.tu-freiberg.de
www.chemie.tu-freiberg.de/tech
Kooperationspartner
Heinrich-Heine-Universität Düsseldorf, Institut für Molekulare Enzymtechnologie Jülich
JFC - Juelich Fine Chemicals GmbH, Jülich
Consortium für elektrochemische Industrie GmbH, München